Palladium er et grunnstoff som har atomnummer 46 og atomsymbol Pd. I ren form er det et metall som ligner sølv. Palladium er plassert som nummer to i gruppe 10 i periodesystemet. Det er et edelmetall som er mykt og duktilt, men det er noe seigere og hardere enn platina, som er i samme gruppe.
Faktaboks
- Uttale
-
palladium
- Etymologi
- av asteroiden Pallas
- Engelsk navn
- palladium
- Atomsymbol
- Pd
- Atomnummer
- 46
- Relativ atommasse
- 106,4
Det er seks stabile isotoper av palladium: 102Pd (1,02 prosent), 104Pd (11,14 prosent), 105Pd (22,33 prosent), 106Pd (27,3 prosent), 108Pd (26,5 prosent) og 110Pd (11,72 prosent).


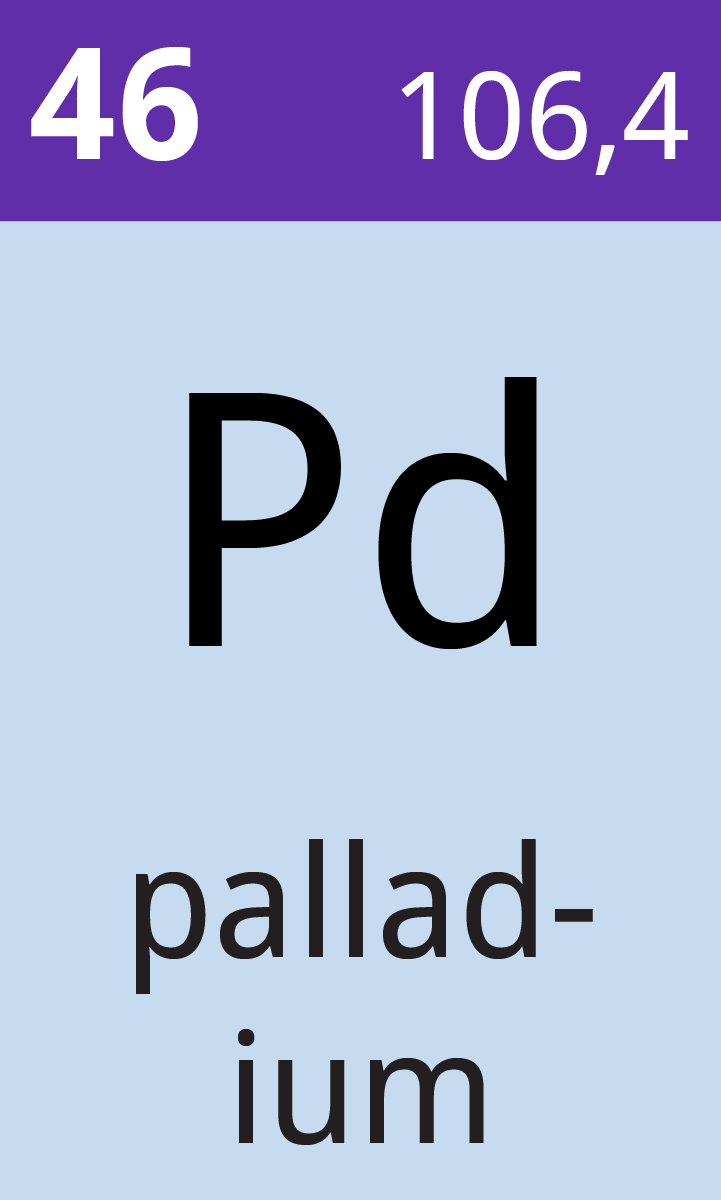





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.